順天堂大学大学院医学研究科ゲノム・再生医療センターの赤松和土特任教授と志賀孝宏研究員、慶應義塾大学医学部生理学教室の岡野栄之教授、西原浩司特任助教らの共同研究グループは、iPS細胞の樹立初期(リプログラミング期)の細胞培養に3つの化合物を添加することで、iPS細胞の分化成熟能力を著しく高める技術を開発しました。
iPS細胞はさまざまな種類の細胞に分化誘導することが可能であるため、再生医療や治療薬開発、疾患メカニズム研究などに応用されています。しかし、成熟するには時間を要し、さらに、細胞株(クローン)ごとに分化成熟能力は大きく異なることから、再生医療に応用するためには、目的の細胞に効率よく分化誘導できるクローンを事前に選別しなければならず、時間的・経済的負担は非常に大きくなっているのが現状です。
今回、共同研究グループは、マウスのiPS細胞を作製する際、培養液に「3i」と呼ばれるMEK阻害剤(PD184352)、GSK3β阻害剤(CHIR99021)、FGF受容体阻害剤(SU5402)の3つの化合物を添加して、体細胞が多能性を獲得するリプログラミング(注1)を行うことで、1.iPS細胞がグリア細胞(注2)に分化する能力を持つ成熟した神経幹細胞に効率よく短期間で分化すること、2.作製されたすべてのクローンにおいて分化誘導期間の短縮傾向が認められること、3.作製されたiPS細胞が発生初期段階に見られる遺伝子を強く発現していること、を発見しました。また、リプログラミング後に3iを添加しても分化成熟能力は高まらないため、初期時の培養条件が大きく影響することも明らかになりました。今回の成果は、今後ヒトiPS細胞にも応用されることにより、再生医療分野での臨床応用や疾患研究においても大きく寄与できると期待されます。
本研究成果は、2019年1月31日正午(米国東部時間)に、国際幹細胞学会(ISSCR)の公式科学誌である『Stem Cell Reports』のオンライン版に掲載されました。
1.研究の背景
2006年に京都大学の山中伸弥教授らによって開発されたiPS細胞技術によって、病気の仕組みを解明する研究や再生医療が大きな進歩を続けています。iPS細胞は、ごくわずかな皮膚や血液の細胞に数種類の遺伝子を導入することで発生初期に近い状態に戻った多能性細胞であり、従来生きた細胞を調査・分析することが困難であったヒトの神経細胞でさえも、iPS細胞技術によって実験的に解析をすることが可能になりました。
実際のさまざまな病気や疾患の再生医療にiPS細胞を応用していくためには、病状が進行しきっていない治療可能な時期にiPS細胞を短期間かつ効率的に目的の細胞へ分化誘導する必要があります。しかし、人工誘導細胞であるiPS細胞は、分化した細胞へ成熟するために要する時間が生体内の幹細胞に比べてとても長く、また、同じドナーの体細胞から同じ条件でiPS細胞を複数作製しても、それぞれの細胞株(クローン)ごとに分化成熟能力は大きく異なります。再生医療の現場でiPS細胞を活用するためには、目的の細胞に効率よく分化誘導でき、その中に腫瘍の原因となる未分化細胞を含まないようなクローンを事前に選別しなければならず、その作業に費やされる時間的・経済的負担が非常に大きくなっています。
そこで本研究では、従来よりも効率よく短期間で分化成熟することが可能なiPS細胞を作製するシステムを構築することを目標とし、iPS細胞の樹立と分化成熟の評価が迅速に行えるマウス細胞を用いて実験・解析を行いました。
2. 研究の成果と意義
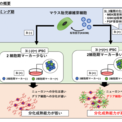
今回の研究では、第一に、元の体細胞からiPS細胞を作製する過程を、初期の「リプログラミング期」とiPS細胞化した後の「維持期」に分け、2つの時期の培養条件を変えることによって、作製されたiPS細胞の分化成熟能に違いがでるかを解析しました。
いくつかの化合物で解析を行ったところ、マウスiPS細胞の未分化能や多能性に関わる細胞内シグナルを調節する化合物カクテルである「3i」(MEKという酵素の阻害剤、GSK3βという酵素の阻害剤、FGF受容体阻害剤)を用いてリプログラミングして作製したiPS細胞は、グリア細胞に分化する能力を持つ成熟した神経幹細胞に短期間で効率的に分化する能力を有することが明らかになりました。すなわち、従来の方法でiPS細胞を作製し、神経幹細胞に分化誘導させると、最初のうちはクローンのほとんどがグリア細胞に分化する能力を持たない未熟な神経幹細胞が出現し、その後徐々にグリア細胞への分化能力を獲得していきますが、今回3iを用いて作製したiPS細胞((+)/(+)群)を10クローン以上解析したところ、対照群((-)/(+)群)や3iを用いずに作製・維持したiPS細胞((-)/(-)群)と比べて、すべてのクローンにおいて、成熟した神経幹細胞が持つグリア細胞に分化する能力を短期間で獲得していることを確認しました。この結果から、リプログラミング時の培養条件はiPS細胞の持つ分化成熟能力に大きく影響することが分かりました(図1)。 一方で、この結果はリプログラミング時の細胞培養条件の改変によって、クローンごとのiPS細胞の分化成熟能のばらつきを克服できる可能性も示唆していると考えられます。

生物の発生初期は、受精卵から二細胞期→四細胞期→八細胞期→…→胚盤胞期と分化していきます。通常のiPS細胞は胚盤胞期と同様の発生段階に相当するとされていますが、3iを用いて作製したiPS細胞は、従来のiPS細胞よりもさらに初期胚に近い遺伝子群が高発現しているということになります。
この二細胞期に特異的な遺伝子群が、iPS細胞の分化成熟能にどのように寄与するかのメカニズムは今回明らかにはなっていませんが、リプログラミング条件を変えることで特徴的な遺伝子発現パターンを有するiPS細胞が作製されたことを示唆しています(図2)。

本研究の最も大きな意義は、「リプログラミング(初期化)時の培養条件を改変することによってiPS細胞の持つ分化成熟能力を促進する」という新しいコンセプトを提唱したことです。マウスとヒトではiPS細胞の多能性維持の機構が異なっているため、単純に同じ化合物をヒトに用いることは難しいですが、本研究のコンセプトを端緒に、近い将来ヒトiPS細胞の作製方法が改変され、分化成熟能力の速度やクローンごとのばらつきが改善されれば、再生医療分野でのiPS細胞の貢献は益々大きなものになると期待されます。
4. 特記事項
本研究は、JSPS科研費 JP12J07356、文部科学省(MEXT)私立大学戦略的研究基盤形成支援事業(順天堂大学)、慶應義塾大学博士課程学生研究支援プログラムの支援を受けて行われました。
5. 論文
タイトル:Induced pluripotent stem cells reprogrammed with three inhibitors show accelerated differentiation potentials with high levels of 2-cell-stage marker expression
日本語訳:3つの化合物を用いて初期化・作製したiPS細胞は、高い分化成熟能力と、二細胞期胚特異的遺伝子の高い発現を有する
著者名:西原浩司1*、志賀孝宏2*、中村衣里3、秋山智彦4、佐々木貴史5、鈴木禎史1、洪実4、多田昇弘3、岡野栄之1**、赤松和土1,2**
(*:共筆頭著者 **:責任著者)
1.慶應義塾大学医学部生理学
2.順天堂大学大学院医学研究科ゲノム・再生医療センター
3.順天堂大学大学院医学研究科老人性疾患病態・治療研究センター
4.慶應義塾大学医学部坂口光洋記念 システム医学講座
5.慶應義塾大学医学部百寿総合研究センター
掲載誌:「Stem Cell Reports」オンライン版
【用語解説】
(注1)リプログラミング:体細胞が多能性(胎盤以外のほとんど全ての細胞に分化できる能力)を獲得する段階。iPS細胞は、山中因子とよばれるいくつかの遺伝子(転写因子)を体細胞に導入することによって作製される。体細胞が多能性を獲得するまでにはある程度の日数(動物種によって異なる)を要する。
(注2)グリア細胞:脳を構成する神経細胞以外の細胞群。神経細胞の機能を補助する役割があると考えられている。
配信元企業:学校法人 順天堂



コメント